Pour indications utiles à résoudre les travaux pratiques accédez: Instructions et Interpretations.
Notions introductifs
Une catégorie importante des études cliniques est celle qui évalue la relation entre un ou plusieurs facteurs de pathogénicité et certains maladies. Dans ces études, la relation entre le(s) facteur(s) et l'occurrence d'une maladie est évaluée, ou plutôt si un facteur particulier modifie la progression d'une maladie (amélioration ou, au contraire, agravation).
Les facteurs de pathogénicité (qui sont également appelé facteurs pronostiques) peuvent être: des facteurs de risque (favorisant la survenue d'une maladie) ou des facteurs de protection (prévenir la maladie ou aider à guérir).
L'étude de la relation entre les facteurs pronostiques possibles et la maladie peut être réalisée par tous les types de collecte de données sans lesquels le chercheur n'intervienne.
Dans l'étude cas-temoin on part de la prémisse que la maladie est rare. Par conséquent les cas sont d'abord identifiés: sujets atteints d'une maladie donnée. Puis les témoins sont choisis: sujets qui n'ont pas la maladie et qui ont des caractéristiques similaires aux celles des cas (sexe, âge, statut socio-économique). Ce n'est qu'après que nous recherchons des facteurs pronostiques dans ces groupes par des méthodes rétrospectives ou transversales. Les méthodes d'identification des facteurs pronostiques peuvent inclure: des tests de laboratoire, des questionnaires standardisés, l'entretien avec le sujet / les membres de la famille, ou la consultation des feuilles d'observation des sujets inclus dans l'étude.
Points forts de l'étude cas-témoins:
- Efficace pour les maladies rares ou avec une longue période de latence
- Relativement facile à réaliser (pas cher, ils prennent un peu de temps)
- Permettent l'analyse de plusieurs facteurs prédictifs
Points faibles de l'étude cas-témoin:
- Il peut offrir des informations erronées (par exemple, les sujets oublient qu'ils ont été exposés à certains facteurs, ou, par contre, les sujets malades ont la tendance de se souvenir même des expositions non significatives)
- Le temps qui s'écoule entre le début de l'exposition et l'apparition de la maladie peut être difficile à déterminer.
Example d’étude cas-témoin
Un exemple d'étude cas-témoins est celui réalisé par les auteurs Destaalem Gebremedhin, Haftu Berh și Kahsu Gebrekirstos, intitulé „Risk Factors for Neonatal Sepsis in Public Hospitals of Mekelle City, North Ethiopia,2015: Unmatched Case Control Study”, publié en 2016, revue PLOS ONE (ISI, IF:2.80, Q1).
Source de l'article:
http://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0154798&type=printable
Définitions utilisées dans l’étude :
Septicémie néonatale – syndrome de réponse inflammatoire systémique en présence ou à la suite d'une infection avérée ou suspectée chez un nouveau-né. L'infection pourrait être bactérienne, virale, fongique.
Scénario d’étude - example
Gebremedhin D et al. ont mené une étude sur les nouveau-nés enregistrés dans les hôpitaux publics de Mekelle, dans le nord de l'Éthiopie, de décembre 2014 à juin 2015, afin d'identifier les facteurs de risque du sepsis néonatal.
Les données nécessaires à l'étude ont été recueillies à partir des dossiers médicaux de nourrisson et d'un questionnaire semi-structuré appliqué aux mères.
Deux groupes de sujets ont été compilés dans l'étude: un groupe de 78 nouveau-nés diagnostiqués avec septicémie néonatale et un groupe témoin (156 nouveau-nés sans sepsis).
Les critères d'inclusion pour les cas étaient:
- Les nouveau-nés enregistrés dans les unités de soins intensifs pédiatriques ou néonatals des hôpitaux publics de Mekelle City, au nord de l'Éthiopie, pendant la période d'étude, avec au moins une des caractéristiques cliniques IMNCI (Integrated Management of Neonatal and Childhood Illness) suivantes: fièvre ≥ 37,5 ° C) ou hypothermie (≤ 35,5 ° C), respiration rapide (≥ 60 respirations par minute), tirage intercostal, mouvements seulement quand ils sont stimulés, convulsions, léthargie ou inconscience ;
et au moins 2 critères hématologiques:
nombre total de globules blancs (15 000 cellules / mm3 ou> 7500 cellules mm3), taux de sédimentation des érythrocytes (> 15 / 1h), nombre de plaquettes (> 440 cellules / mm3).
Les critères d'inclusion pour les témoins étaient:
- • Les nouveau-nés qui n'ont pas accomplis les critères clinique ou hématologique de la septicémie et qui étaient inscrits dans des unités de soins pédiatriques ou de soins intensifs néonatals des hôpitaux publics de Mekelle, dans le nord de l'Éthiopie pendant la période d'étude.
Protocole de recherche
1. But et objectifs
Le but de cette étude était d'évaluer l'association entre les antécédents d'infection urinaire de la mère ou d'infection sexuellement transmissible et la septicémie néonatale.
Objectifs:
- • Tester le lien entre le facteur (rupture prolongée de la membrane) et la maladie (septicémie néonatale):
- • Étude de la taille de l'effet (Quantification de l'importance de la liaison): Estimation de l'indicateur de l'odds ratio (OR)
2. Domaine de la recherche: évaluation des facteurs prognostiques (de risque ou de protection).
3. Type d’étude:
- En fonction des objectifs de l’étude: analytique
- En fonction des résultats visés: observationnelle
- En fonction de la technique utilisée pour choisir les groupes: sans appariement (engl. unmatched)
Remarque:
- étude analytique = les groupes de patients sont comparés, les associations entre différentes caractéristiques cliniques sont testées tandis qu'une étude descriptive décrit un certain nombre de cas ou un seul groupe de patients et aucune association / lien possible n'est étudié.
- étude observationnelle = le type d'étude qui n'implique pas l'intervention d'un chercheur sur la progression de la maladie.
- Appariement (dans le cas d'études dans lesquelles des groupes sont comparés) = pour chaque sujet dans le groupe de cas / exposé, il y a un sujet avec des caractéristiques similaires pour le groupe témoin / non exposé. Ex. Correspondant par: même sexe, âge similaire (identique ou +/- 2 ans), mêmes facteurs de risque (par exemple diabétiques). L’appariement peut être fait 1: 1 ou 1: 2, 1: 3, 1: 4 (c'est-à-dire un cas à 1/2/3/4 témoins).
4. Population accessible et l'échantillon étudié
Population accessible
Nouveaux-nés nés dans les unités de soin d'obstétrique dans les hôpitaux publics de Mekelle, en Ethiopie du Nord, entre décembre 2014 - juin 2015.
L'échantillon étudié
Critères d'inclusion
Nouveaux-nés arrivant dans le monde entre décembre 2014 - juin 2015 dans les unités de soin d'obstétrique dans les hôpitaux publics de Mekelle, en Ethiopie du Nord.
Critères d'exclusion
Remarque: Dans ce scénario, les critères d'exclusion ne sont pas mentionnés.
Taille de l'échantillon
Les auteurs déclarent que la taille de l'échantillon a été estimée à 234 sujets pour une erreur de type 2 de 0,20 (donc une puissance de l'étude de 80%), une proportion d'AIU / AIS maternels chez les nouveau-nés sans sepsis de 13% ( déterminé dans une autre étude de population similaire), ratio de contrôle / cas = 2:1, et un OR = 2,87. Nous croyons que la taille de l'échantillon était suffisante.
5. Méthode de collecte des données
- En fonction de la population enquêtée: échantillonnage aléatoire systématique - voir la section Méthode de l'article.
- En fonction de la durée de la collecte des données: rétrospective longitudinale.
- En fonction de la façon dont le groupe ou les groupes de sujets ont été constitués: cas-témoins (les deux groupes ont été définis en fonction de la présence / absence de sepsis néonatal).
Remarque: Types d'échantillonnage probabiliste
Échantillonnage aléatoire simple: chaque élément de la population a la même chance d'être inclus dans l'échantillon.
Échantillonnage aléatoire systématique: suppose un choix aléatoire d'un numéro de départ (étape), à partir duquel l'ajout d'une taille fixe donnera une unité (élément) de l'échantillon.
Échantillonnage aléatoire stratifié: consiste à diviser la population de recherche en couches selon certaines caractéristiques (gènes, groupes d'âge) pour soustraire de façon aléatoire des sous-échantillons (groupes) proportionnels à la taille de chaque couche, groupes qui sont ensuite combinés pour obtenir un seul échantillon.
Échantillonnage aléatoire en grappes (angl. cluster): La population de recherche est divisée en grappes et un certain nombre de groupes sont choisis au hasard, toutes les unités (éléments) incluses.
6. Analyse statistique
Caractéristiques démographiques et cliniques de la mère
Âge: variable quantitative continue.
Niveau d'éducation (primaire, secondaire, lycée ou faculté): variable qualitative ordinales.
Antécédents d'infection des voies urinaires (AIU) ou d'infections sexuellement transmissibles (AIS), troubles de l'hypertension, le fond, rupture prolongée de la membrane, fièvre intrapartum: variables qualitatives dichotomiques.
Etat civil, Religion, Ethnicité, Occupation: variables qualitatives nominales.
Caractéristiques démographiques et cliniques du nouveau-né
Genre du nouveau-né (H / F), score d'Apgar_1 minute (7 codé avec 1 vs ≥ 7 codé avec 0); score d'Apgar_5minute (7 codé avec 1 vs ≥ 7 codé avec 0), réanimation à la naissance (oui ; non) Septicémie (oui ; non): variables qualitatives dichotomiques.
Poids à la naissance (1500-2500 grammes ; ≥2500 grammes), âge gestationnel ( 42 semaines): variables qualitatives ordinale.
Description des données: Cela peut être faite soit à l'aide d'un tableau de fréquence ou d'une tableau de contiguïté soit d'une graphique à colonne verticale ou horizontale.
L'association bivariée entre le facteur d'exposition et la maladie sera démontrée par des testes statistiques comme Chi deux ou le test exact de Fisher (ce dernier s'applique si au moins 20% des fréquences dans le tableau de contingence théorique 5).
Association multivariée entre exposition et maladie: par régression logistique multivariée.
Afin de quantifier l'importance de l'association entre le facteur d'exposition et la maladie l'odds ratio (OR) de la septicémie et l'intervalle de confiance associé de 95% (IC) sont calculés.
- • Si l’OR estimé > 1 et les deux extrémités (les limites supérieur et inférieur) de l'intervalle de confiance sont supérieurs à 1, alors on peut dire que le facteur d'exposition est un facteur de risque.
- • Si l’OR estimé 1 et les deux extrémités (les extrêmes supérieur et inférieur) de l'intervalle de confiance sont inférieurs à 1, alors on peut dire que le facteur d'exposition est un facteur de protection.
- • Si l’OR estimé = 1 ou intervalle de confiance contient le 1, nous n’avons pas assez de preuves pour démontrer que le facteur d'exposition est un facteur de risque ou de protection.
Remarque: L’OR peut être déterminé sous forme non ajustée (dénommé « crude odds ratio ») représentant un risque de maladie chez des patients exposés et non-exposées et / ou sous la forme ajustée (dénommé « adjusted odds ratio ») représentant le risque de maladie chez les patients exposés par rapport aux non exposés ajustés par la présence d'autres covariables.
Les résultats attendus. L’analyse et présentation des données
1. Description de l’échantillon
Dans cette étude, la description des caractéristiques mesurées sur l'échantillon a été faite en utilisant des tableaux de contingence présentés sous une forme condensée dans la section Résultats de l'article.
Tableau 1. Description des caractéristiques socio-démographiques des groupes d'étude
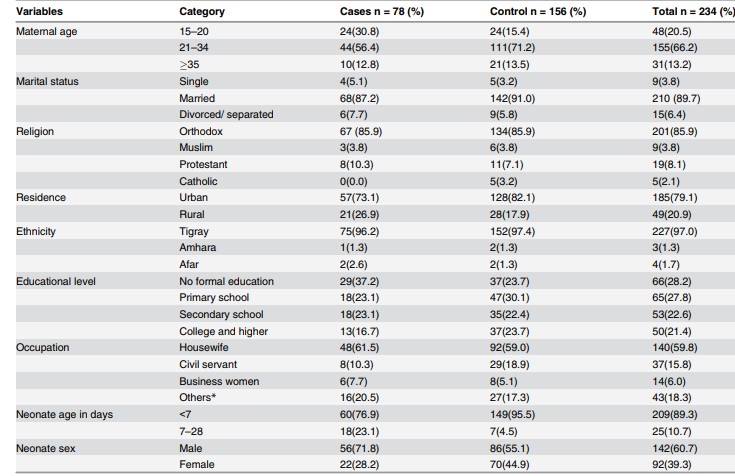
Source: Gebremedhin D, Berhe H, Gebrekirstos K. Risk Factors for Neonatal Sepsis in Public Hospitals of Mekelle City, North Ethiopia, 2015: Unmatched Case Control Study. PLoS One. 2016 May 10;11(5):e0154798.
2. Asocierea bivariată și multivariată între antecedentele de infecție urinară sau infecție cu transmitere sexuală și sepsis neonatal.
Tabelul de contingenţă dintre factorul de risc (AIU/AIS) şi boală (sepsis):
1. Association bivariée et multivariée entre un antécédent d'infection urinaire ou une infection sexuellement transmissible et une septicémie néonatale.
- • Le tableau de contingence entre le facteur de risque (AIU / AIS) et la maladie (septicémie):
|
Septicémie (oui) |
Septicémie (non) |
Total |
|
|
AIU/AIS (oui) |
40 |
21 |
61 |
|
AIU/AIS(non) |
38 |
135 |
173 |
|
Total |
78 |
156 |
234 |
|
AIU/AIS= les antécédents d'une infection urinaire ou d'une infection sexuellement transmissible de la mère |
|||
Tableau 2. Association bivariée et multivariée entre AIU / AIS et septicémie néonatale
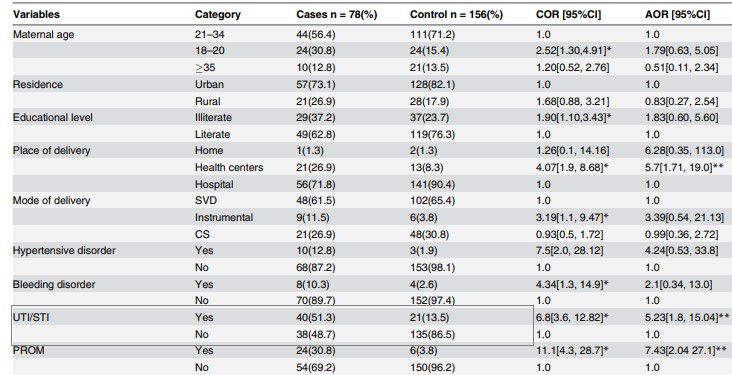
UTI/STI= les antécédents de la mère d'une infection urinaire ou d'une infection sexuellement transmissible
Source: Gebremedhin D, Berhe H, Gebrekirstos K. Risk Factors for Neonatal Sepsis in Public Hospitals of Mekelle City, North Ethiopia, 2015: Unmatched Case Control Study. PLoS One. 2016 May 10;11(5):e0154798.
Graphique à colonnes pour la relation entre le facteur de risque et la maladie (réalisé en Excel):
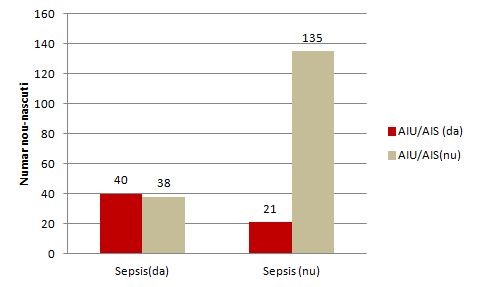
Figure 1. La relation entre l'histoire de la mère AIU / AIS et la septicémie néonatale
- Odds Ratio (OR non ajustée) et l'intervalle de confiance associé (Tableau 2); le programme EpiInfo peut être utilisé pour calculer l'estimateur ponctuel et l'intervalle de confiance associé; format d'écriture des résultats: estimateur ponctuel (95% Ci: limite inférieure - limite supérieure):
OR=6,8 (95% CI: 3,6-12,8)
- La valeur de p (réalisé avec Epiinfo; est rapporté comme p = valeur - le nom du test utilisé, avec un maximum de 3 décimales, si p 0.001 alors écrire "p 0.001"):
p0,001-Test Chi deux
Remarque: Dans cette étude, les auteurs ont également estimé l’OR ajusté en fonction de différentes associations telles que l'âge de la mère, le fond, le type de naissance, la rupture prolongée de la membrane, etc.
Interpréter les données. Discussions
1. Interpréter les résultats statistiquement
L'objectif de l'étude était de tester et de quantifier l'association entre l'histoire de la mère AIU / AIS et la septicémie néonatale
D'un point de vue statistique, le test d'association a été fait en formulant deux hypothèses (l'hypothèse nulle et l'hypothèse alternative), l'hypothèse nulle étant celle testée. Dans le cas de son rejet, nous affirmons que nous sommes en faveur de l'hypothèse alternative.
L’hypothèse nulle: Il n'y a pas d'association significative entre l'historique de la mère AIU / AIS et la septicémie néonatale
L’hypothèse alternative: Il existe une association significative entre l'historique de la mère AIU / AIS et la septicémie néonatale
Parce que p 0,05, il existe une association significative entre l'historique de la mère AIU / AIS et la septicémie néonatale
D'un point de vue statistique, la quantification de l'association a été réalisée par une estimation ponctuelle de l'indicateur OR (non ajusté et ajusté) et de l'intervalle de confiance de 95% qui lui est associé.
L’estimateur ponctuel:
OR = 6,8: les nouveau-nés dont les mères avaient des antécédents d'AIU / AIS pendant la grossesse avaient 6,8 fois plus de chances de développer une septicémie que les nouveau-nés dont les mères n'avaient pas d'AIU / AIS.
Intervalle de confiance pour OR:
IC 95%: 3,6-12,8 - nous sommes sûrs à 95% que l'odds ratio de la population étudiée se situera entre 3,6 et 12,8 (si nous extrayons des échantillons de la même taille de la population étudiée, 95% des les CI contiendront l’odds ratio dans la population cible des nouveau-nés).
En outre, OR> 1 et les deux extrémités de l'intervalle de confiance étaient supérieures à 1, de sorte que les antécédents de la mère AIU / AIS sont un facteur de risque de septicémie néonatale.
Remarque: Dans l'étude présentée, les auteurs ont également analysé l'association AIU / AIS dans le contexte de la présence d’autres covariables (facteurs maternels et néonatals) tels que l'hypertension artérielle, la fièvre intrapartum, les complications à la naissance, le score Apgar faible à 5 minutes, etc. – et obtenir un OR ajusté = 5,23, 95% IC: 1,8 - 15,04. Puisque les résultats étaient statistiquement significatifs, on peut soutenir que l'historique de la mère AIU / AIS restent un facteur de risque indépendant pour le sepsis néonatal.
2. Interpréter les résultats cliniquement
La taille de l'indicateur OR dans contexte clinique:
- Très important / modéré / pas important
OR = 6,8 indique une amplitude modérée prenant en compte que des études similaires réalisées sur la même population ont obtenu un OR = 12,9 (voir la section Discussion de l'article).
Précision du résultat (voir la taille de l'intervalle de confiance):
- Relativement précis / imprécis (intervalle large - résultats imprécis, intervalle étroite - résultats précis)
L'intervalle de confiance de 95%: 3.6-12.8 peut être considéré comme un intervalle relativement précis
- Relation clinique relativement importante (les deux extrémités ont une valeur clinique significative)
La relation entre le facteur maternel (antécédents AIU / AIS pendant la grossesse) et (dans la simulation de la taille de l'échantillon, les auteurs considérant une taille d'effet OR = 2,87 comme étant d'intérêt).
Conclusions de l’étude
Le facteur maternel qui est l'historique de l'infection urinaire ou de l'infection sexuellement transmissible de la mère contribue au risque de septicémie néonatale, étant même un facteur de risque indépendant.
Sur le serveur de discipline de votre répertoire, vous créez un directeur LAB02. Téléchargez le fichier ci-dessous dans ce répertoire et remplissez les espaces vides. Enregistrez le fichier.
SECȚIA FRANCEZĂ – Șef lucrări Dr. Daniel Leucuța
|
N0. |
Thèmes |
Objectifs pédagogiques (concepts requis) |
|
1 |
Introduction. Importance de la méthodologie de la recherche médicale. Variabilité. |
Motive et explique la nécessité d'étudier et de comprendre la bonne conception et la mise en œuvre des études médicales, ainsi que les règles de l'écriture médicale et la diffusion appropriée des résultats de la recherche, dans leurs positions futures en tant que chercheurs “créateurs” (la thèse de licence) et chercheurs "Consommateurs" (médecins). Définit l'information médicale, les données médicales et son traitement (informatique médicale). Définit la variabilité biologique et les variables médicales. Classifie les variables médicales par type. Exemplifie les types des variables médicales. Reconnaît les types de variables médicales dans des cas spécifiques. Explique les moyens de recueillir des informations médicales précises et de les coder en tant que données médicales. Explique les façons de présenter et de mesurer les données médicales (échelles de mesure) et leur interprétation comme information médicale. Collecte et code correctement les informations médicales (transforme les informations en données correctement). Présente correctement les données médicales (reconstruit correctement les informations des données). |
|
2 |
Séquences (phases) de la recherche médicale. Documentation bibliographique. |
Explique les séquences (étapes / phases) de la recherche médicale. Explique l'utilité de la documentation bibliographique dans la recherche médicale et la pratique médicale. Explique les étapes de recherche dans lesquelles la documentation bibliographique est nécessaire. Exemplifie les bases de données médicales bibliographiques couramment utilisées. Définit et applique des stratégies de recherche bibliographique en utilisant la technique PICO pour des situations spécifiques. Utilise l'ordinateur pour la documentation bibliographique: applique des stratégies de recherche bibliographique en utilisant la technique PICO dans PubMed (MEDLINE). Formule des questions de recherche appropriées. Associée correctement les hypothèses à des questions de recherche pertinentes. Applique des stratégies de recherche pour identifier les sources médicales dans la bibliothèque de UMF Cluj. Choisir la documentation pertinente pour des questions de recherche spécifiques. Répertorie les composants d'un catalogue bibliographique. Crée un catalogue bibliographique correct en format électronique sur une question de recherche donnée. Explique l'utilité des références dans la recherche. Explique et applique le système de référencement de Vancouver pour différents types de textes médicaux (article original, livre, etc.). Écrit correctement divers types de références selon le système de Vancouver. |
|
3 |
Séquences (phases) de la recherche médicale. Le protocole de recherche. Variables d'étude. Types de recherche. L'équipe de recherche. |
Formule les séquences (phases) d'une étude médicale. Nommer et expliquer les composantes d'un protocole / plan de recherche médicale. Identifie les composantes du protocole de recherche pour des scénarios de recherche spécifiques. Nommer et expliquer les types de collecte de données dans les études médicales. Nommer et expliquer les types d'échantillonnage (probabiliste et non probabiliste) dans les études médicales. Formule le but et les objectifs pour des scénarios de recherche spécifiques. Formule des hypothèses pour des scénarios de recherche spécifiques. Reconnaître correctement le domaine de la recherche clinique. Reconnaît et classe les études médicales par type (en fonction des objectifs et des résultats escomptés). Définit correctement la population cible et la population accessible d'une étude médicale. Formule correctement les critères d'inclusion et d'exclusion pour un échantillon d'étude dans un scénario de recherche donné. Identifie correctement le type de collecte de données pour un scénario de recherche donné. Dresse la liste des méthodes permettant de décrire différents types de variables dans des études médicales spécifiques (à l'aide de tableaux, de graphiques et de statistiques descriptives). Appliquer correctement des méthodes pour décrire différents types de variables dans des études médicales spécifiques à l'aide de logiciels statistiques (tableaux, graphiques et statistiques descriptives). Explique le sens des résultats descriptifs des études médicales concrètes (tableaux, graphiques et statistiques descriptives). Lister les méthodes correctes d'analyse des données pour différents types de variables dans les études médicales concrètes (tests statistiques, corrélation, modèles de régression, indicateurs statistiques et médicaux). Appliquer des méthodes correctes d'analyse des données pour différents types de variables dans des études médicales concrètes utilisant des logiciels statistiques (tests statistiques, corrélation, modèles de régression, indicateurs statistiques et médicaux). Explique la signification des résultats analytiques spécifiques des études médicales (tests, corrélation, modèles de régression, indicateurs statistiques et médicaux). |
|
4 |
Études descriptives. Études évaluant les facteurs pronostiques des maladies. |
Explique les études descriptives comme sources des nouvelles hypothèses. Explique les questions de recherche descriptives, par opposition aux questions de recherche analytique. Définit les études d'évaluation des facteurs pronostiques (impliqués dans différentes pathologies). Explique différents types d'études d'évaluation des facteurs pronostiques. Explique la méthodologie des études d'évaluation des facteurs pronostiques. Construit des tableaux de contingence basés sur des données provenant de scénarios de recherche spécifiques des facteurs pronostiques ou basés sur des fichiers de données. Tester l'existence de liens entre les facteurs pronostiques et les maladies. Calcule des indicateurs médicaux / sanitaires pour quantifier l'importance des liens entre les facteurs pronostiques et les maladies. Évalue l'existence d'un lien de causalité entre la présence de facteurs pronostiques et le développement de maladies d'intérêt. Choisir et justifier des indicateurs médicaux appropriés pour quantifier la relation entre les facteurs pronostiques et les maladies. Interpréter statistiquement les indicateurs médicaux utilisés pour quantifier la relation entre les facteurs pronostiques et les maladies (estimations ponctuelles et leurs intervalles de confiance de 95%). Interprète cliniquement les indicateurs médicaux utilisés pour quantifier la relation entre les facteurs pronostiques et les maladies (estimations ponctuelles et leurs intervalles de confiance à 95%). Évalue la précision et l'importance clinique de ces résultats. Discrimination entre précision et précision / validité des résultats. |
|
5 |
Études évaluant les méthodes / tests de diagnostic.
|
Définit les études d'évaluation des tests diagnostiques. Explique les quatre phases de l'évaluation des tests diagnostiques. Explique la méthodologie des études évaluant les tests diagnostiques. Construire des tableaux de contingence basés sur des données provenant de scénarios de recherche spécifiques des tests de diagnostic ou basés sur des fichiers de données. Tester l'existence de liens entre les résultats des tests diagnostiques comparés. Calcule des indicateurs médicaux pour quantifier les qualités des tests diagnostiques. Choisit et justifie des indicateurs médicaux adaptés pour mesurer les qualités des tests diagnostiques (dépistage / confirmation). Interpréter statistiquement les indicateurs médicaux utilisés pour quantifier les qualités des tests diagnostiques (estimations ponctuelles et leurs intervalles de confiance à 95%). Interprète cliniquement les indicateurs médicaux utilisés pour quantifier les qualités des tests diagnostiques (estimations ponctuelles et leurs intervalles de confiance à 95%). Évalue la précision et l'importance clinique de ces résultats. Discrimination entre précision et précision / validité des résultats. |
|
6 |
Études évaluant les approches thérapeutiques / les options de traitement. |
Définit les études d'évaluation des options thérapeutiques. Explique différentes approches dans l'évaluation des options de traitement. Explique les approches méthodologiques possibles des études d'évaluation expérimentale des approches thérapeutiques (types d'essais cliniques, Phases I, II, III, IV). Construit des tableaux de contingence basés sur des données issues de scénarios de recherche spécifiques d'essais cliniques, ou basés sur des fichiers de données. Tester l'existence des liens entre les facteurs thérapeutiques évalués et les événements expérimentaux définis dans l'étude; Évaluant l'existence d'un lien de causalité entre eux. Calcule des indicateurs médicaux pour quantifier l'efficacité thérapeutique / la sécurité. Choisit et justifie des indicateurs médicaux appropriés pour mesurer l'efficacité thérapeutique / la sécurité. Interpréter statistiquement les indicateurs médicaux utilisés pour quantifier l'efficacité thérapeutique / la sécurité (estimations ponctuelles et leurs intervalles de confiance à 95%). Interprète cliniquement les indicateurs médicaux utilisés pour quantifier l'efficacité / la sécurité thérapeutiques (estimations ponctuelles et leurs intervalles de confiance à 95%). Évalue la précision et l'importance clinique de ces résultats. Discrimination entre précision et précision / validité des résultats. |
|
7 |
Études d'analyse de survie |
Définit les études de survie (études d’évaluation du temps passée jusqu’à l’apparition d’un événement). Explique les principales caractéristiques des variables de survie. Explique la méthodologie des études de survie. Tester l'existence de liens entre les facteurs pronostiques et le temps / la probabilité de survie. Calcule les indicateurs médicaux pour quantifier l'importance des liens entre les facteurs pronostiques et le temps / la probabilité de survie. Choisir et justifier les indicateurs médicaux appropriés utilisés pour quantifier l'importance des liens entre les facteurs pronostiques et le temps / la probabilité de survie. Interpréter statistiquement les indicateurs médicaux utilisés pour quantifier l'importance des liens entre les facteurs pronostiques et le temps / la probabilité de survie (estimations ponctuelles et leurs intervalles de confiance à 95%). Interprète cliniquement les indicateurs médicaux utilisés pour quantifier l'importance des liens entre les facteurs pronostiques et le temps / la probabilité de survie (estimations ponctuelles et leurs intervalles de confiance à 95%). Évalue la précision et l'importance clinique de ces résultats. Discrimination entre précision et précision / validité des résultats. |
|
8 |
Validité de l'étude. Mise en évidence des erreurs dans les études médicales |
Définit les erreurs aléatoires. Définit les erreurs systématiques (biais). Définit et illustre les facteurs de confusion. Classifie et définit les principaux types de biais de sélection. Explique des méthodes qui peuvent être utilisées pour prévenir / réduire / contrôler les biais de sélection. Classifie et définit les principaux types de biais d'observation / information. Explique des méthodes qui peuvent être utilisées pour prévenir / réduire / contrôler le biais d'observation / d'information. Classifie et définit les principaux types de biais d'analyse. Explique des méthodes qui peuvent être utilisées pour prévenir / réduire / contrôler les biais d'analyse. Explique des méthodes qui peuvent être utilisées pour prévenir / réduire / contrôler les facteurs de confusion. Explique et distingue la précision et l'exactitude des résultats de la recherche. Explique et distingue la validité et la relevance/pertinence des résultats de la recherche. Reconnaît différents types de biais dans des scénarios spécifiques d'études médicales. Explique l'influence des différents types de biais sur les résultats de l'étude dans des scénarios spécifiques d'études médicales. Reconnaît les facteurs de confusion dans des scénarios spécifiques d'études médicales. Explique l'influence des facteurs de confusion sur les résultats de l'étude dans des scénarios spécifiques d'études médicales. |
|
9 |
La médecine fondée sur des preuves/évidences/factuelle (MBE) (EBM) |
Définit la médecine fondée sur des preuves (EBM) et la recherche fondée sur des preuves. Classifie les types d'études dans la hiérarchie des preuves pour les domaines diagnostique, pronostique, prophylactique et thérapeutique de la recherche. Explique les critères d'évaluation de la validité des études dans les domaines diagnostique, pronostique, prophylactique, thérapeutique. Explique la pertinence des résultats de l'étude dans la pratique médicale et la recherche médicale. Évalue de manière critique les preuves de la littérature sur des exemples concrets d'études médicales (facteurs de risque ou de protection, tests diagnostiques, approches thérapeutiques). Évalue de manière critique les éléments probants tirés des rapport systématiques sur des exemples concrets. Évalue les résultats de recherche dans la littérature (de PubMed) selon le type d'études, selon la hiérarchie des évidences pour chaque domaine de la recherche clinique: pronostic, diagnostic, thérapie. Explique en termes médicaux (pour les pairs) et critique les résultats scientifiques trouvés dans la littérature. Explique en termes simples (pour les patients) les résultats scientifiques trouvés dans la littérature. |
|
10 |
Meta-analysis |
Définit le rapport systématique et la méta-analyse. Explique la méthodologie d'une revue systématique avec ou sans méta-analyse. Explique le problème de la taille de l'effet. Explique la graphique foret. Décide et justifie les indicateurs appropriés pour la méta-analyse des différents types de résultats suivis (dichotomique, quantitative, survie). Interpréter statistiquement un diagramme foret (estimation ponctuelle et intervalle de confiance à 95%). Interprète cliniquement les résultats d'une méta-analyse (estimation ponctuelle et intervalle de confiance à 95%). Évalue la précision et la validité des résultats d'une méta-analyse. |
|
11 |
Choix des méthodes statistiques |
Définit les tests statistiques. Explique les estimations ponctuelles et les intervalles de confiance. Explique les avantages offerts par les intervalles de confiance sur les résultats des tests statistiques. Nomme les facteurs qui déterminent le choix des méthodes statistiques. Formule les hypothèses nulles et alternatives d'un test statistique pour des scénarios spécifiques de la recherche médicale. Identifie des méthodes statistiques appropriées pour comparer des groupes indépendants dans des situations spécifiques de recherche médicale. Identifie les méthodes statistiques appropriées pour la comparaison des groupes dépendants (appariés) dans des situations spécifiques de recherche médicale. Identifie les méthodes statistiques appropriées pour évaluer la relation entre deux ou plusieurs variables pour des situations spécifiques de recherche médicale. |
|
12 |
Écriture médicale et communication des résultats de la recherche |
Enumére et décrire les principaux types de publications scientifiques médicales. Énumère et explique les objectifs et les qualités de l'écriture médicale scientifique. Énumère et explique les principes de l'écriture scientifique médicale. Décrit la structure et les chapitres d'une thèse de licence en médecine. Indique et explique le contenu de chaque chapitre d'une thèse de licence en médecine. Décrit la structure et les chapitres d'un article de recherche original en médecine. Indique et explique le contenu de chaque chapitre d'un article de recherche original en médecine. Explique la structure, le contenu et les règles de rédaction d'une communication orale à l'appui de la recherche médicale (article ou thèse de fin d'études). Explique la structure, le contenu et les règles de rédaction d'une présentation d'affiche. Explique et discute les principes éthiques régissant l'écriture médicale scientifique. Évalue de manière critique en termes de structure et de contenu un fragment d'article ou d'article proposé pour la lecture et l'évaluation critique. Choisit le type de graphique approprié pour la présentation des résultats en fonction du type et de la nature de la distribution des données (diagrammes circulaires, diagrammes en colonnes, carrés et moustaches, histogrammes, dispersion, courbes de survie de Kaplan-Meier). Explique et applique les règles de la bonne écriture scientifique des résultats de la recherche sous forme de texte, de tableaux et de graphiques. Produit les diapositives pour une présentation orale d'un article ou d'une thèse selon les règles de l'écriture médicale scientifique. |
|
13 |
Éthique de la recherche |
Énumère les phases importantes de l'évolution historique de l'éthique de la recherche médicale. Énumère les déclarations importantes de normes éthiques dans la recherche médicale. Énumère la composition et les fonctions d'un comité d'éthique de la recherche médicale (REC). Énumère les principes éthiques qui régissent la recherche médicale. Explique et discute les principes éthiques qui régissent la recherche médicale. Énumère et explique les types de fraudes et d'inconduite dans la recherche médicale et la publication. Répertorie les organismes de réglementation en matière de recherche médicale et d'éthique de la publication et leurs tâches spécifiques. Identifie et explique la nécessité d'appliquer des principes éthiques dans le contexte de différents types d'études médicales concrètes. Spécifie les procédures d'application des principes éthiques dans le cadre de projets concrets de recherche médicale. |
|
14 |
Modélisation et simulation en recherche médicale |
Définit la modélisation et la simulation dans la recherche et explique leur but. Enumère et illustre les types des modèles utiles dans la recherche médicale (mentale / physique / biologique / mathématique, continue / discrète, déterministe / stochastique). Enumère et explique les étapes de développement d'un modèle mathématique. Enumère et explique les types de simulation d'un modèle mathématique. Exemples de modèles et de simulations dans divers domaines de la recherche médicale. Évalue la corrélation entre les variables quantitatives à l'aide des coefficients de corrélation et des diagrammes de dispersion. Explique et interprète les modèles par des régressions linéaires simples et multiples. |
Validation des examens et bonus
Pour valider l'examen, les notes obtenues dans les examens théoriques et pratiques doivent être supérieures ou au moins égales à 5.
L'examen pratique a un poids de 30% dans le calcul de la note finale. Si le score pratique est inférieur à 10 mais supérieur à 5, le tuteur de groupe peut attribuer jusqu'à 1,5 points de bonus pour l'activité de l'étudiant pendant le semestre.
Pendant les deux examens, les étudiants sont autorisés à consulter un carnet personnel avec des notes manuscrites et des diagrammes. Toutefois, des questions ou des questionnaires d'exemple des années précédentes, des documents imprimés ou copiés, ainsi que des livres, NE sont PAS autorisés et seront considérés comme des cas de fraude à l'examen.
Le test à choix multiple contient 40 questions à résoudre en 80 minutes. Le test sera marqué sur 40 points, avec un score de passage d'au moins 18 points.
Un maximum de 0,25 points de bonus peut être attribué pour chaque cours auquel un étudiant est intervenu de manière constructive (la liste des points de bonus est conservée par le responsable). Ces points peuvent être ajoutés au score final de l'examen écrit, si le score est inférieur à 40.
Méthode de correction:
- Question avec une bonne réponse:
- 5 concordances = 1 point
- moins de 5 concordances = 0 points
- Question avec 2 réponses correctes:
- 5 concordances = 1 point
- 4 concordances = 0,8 points
- moins de 4 concordances = 0 points
- Question avec 3 réponses correctes ou plus:
- 5 concordances = 1 point
- 4 concordances = 0,8 points
- 3 concordances = 0,5 point
- moins de 3 concordances = 0 points
Bibliographie
- Présentations de cours en ligne et activités pratiques en ligne: www.info.umfcluj.ro
- Matériel distribué pendant les cours









