 |
Poziția didactică: Asistent universitar Vechime/experiență: Februarie 2022 Activitate didactică actuală: Lucrări practice de Informatică medicală și biostatistică, respectiv Metodologia Cercetării Științifice pentru studenții Facultăților de Medicină și Medicină Dentară din anul I și II – secția română și franceză. |
|
Contact |
Această adresă de email este protejată contra spambots. Trebuie să activați JavaScript pentru a o vedea. |
Coordonatori:
Sorana D. Bolboacă și Tudor Drugan
Capitolul 1. Importanța biostatisticii medicale (Tudor Drugan)
Capitolul 2. Date și variabile medicale. Formule și funcții excel (Sorana D. Bolboacă)
Capitolul 3. Analiza descriptivă a datelor calitative (Cosmina Ioana Bondor)
Capitolul 4. Analiza descriptivă a datelor cantitative (Ioana-Andreea Gheban-Roșca, Cosmina Ioana Bondor, Andrada Elena Urda-Cîmpean, Sorana D. Bolboacă)
Capitolul 5. Elemente de teoria probabilităților (Tudor Călinici)
Capitolul 6. Distribuția normală: identificarea distribuției datelor cu ajutorul statisticilor descriptive și a reprezentărilor grafice (Sorana D. Bolboacă, Mihaela Iancu, Cosmina Ioana Bondor)
Capitolul 7. Estimatori și intervale de încredere (Cosmina Ioana Bondor, Andrada Elena Urda-Cîmpean)
Capitolul 8. Statistică descriptivă: Alegerea metodei (Vlad Ionuț Nechita, Mădălina-Ana Văleanu)
Capitolul 9. Teste statistice pentru medii (Mihaela Iancu)
Capitolul 10. Teste statistice pentru frecvențe (Daniel-Corneliu Leucuța)
Capitolul 11. Corelații și regresii. Regresia liniară univariată (Mădălina-Ana Văleanu)
Capitolul 12. Statistică inferențială: Alegerea metodei (Andrada Elena Urda-Cîmpean, Mihaela Iancu, Cosmina Ioana Bondor)
Capitolul 13. Modele de subiecte pentru proba practică (Dan Istrate, Ancuța Benedec)
Capitolul 14. Proba practică: Exemple de întrebări (Ioana Țaranu, Mihaela Iancu, Sorana D. Bolboacă)
Exemple de problemeActivitate practică 2 Baza de date BD_EpiExcel.xls
Alegerea metodei statistice. Corelații și regresii. Activitate practică 1Activitate practică 2
Pentru indicații de rezolvare accesați fișierele Indicații Interpretări
Noțiuni introductive
Pentru verificarea clinică a eficienței terapeutice studiile trebuie concepute cu un design experimental riguros, cunoscut sub numele de trial clinic randomizat și controlat (RCT - Randomized Controlled Trial).
Pentru autorizarea și punerea pe piață a unui nou medicament, acest design experimental trebuie aplicat în mod obligatoriu de către compania farmaceutică producătoare, cu scopul de a evalua eficiența terapeutică a noului produs, în cadrul unor trialuri clinice de fază II și III.
În practica dumneavoastră ca viitor medic veți fi confruntat(ă) cu necesitatea cunoașterii acestui design experimental, nu atât în situația descrisă anterior, când studiul va fi planificat și coordonat de departamentul de cercetare al companiei producătoare a noului medicament, cât mai ales în contextul unor studii clinice în care unele medicamente deja autorizate pentru uz uman pot fi re-evaluate în cadrul unor trialuri clinice de fază IV, pentru verificarea eficienței lor în posibile noi aplicații terapeutice.
Un astfel de studiu este și cel exemplificat în continuare, privind eficiența terapeutică a aspirinei în doze reduse, ca tratament adjuvant în ulcerele venoase ale membrelor inferioare.
Ulcerele venoase ale membrelor inferioare sunt cauzate de hipertensiunea venoasă de lungă durată, consecinţă a insuficienţei venoase cronice. Ele apar frecvent la nivelul membrelor inferioare, în regiunea gambei și a maleolelor. Ulceraţia poate fi difuză sau circumscrisă, cu margini neregulate, uşor denivelate, și fundul ulcerației acoperit frecvent de țesut de granulație și depozite de fibrină. Pentru mai multe detalii despre această patologie puteți accesa și acest link.
|
Jull A, Wadham A, Bullen C, Parag V, Kerse N, Waters J. Low dose aspirin as adjuvant treatment for venous leg ulceration: pragmatic, randomised, double blind, placebo controlled trial (Aspirin4VLU). BMJ. 2017;359:j5157. Available from : http://www.bmj.com/content/bmj/359/bmj.j5157.full.pdf |
Conform autorilor acestui studiu, aspirina în doze moderate (300 mg) fusese deja sugerată, în urma altor două trialuri clinice, ca tratament adjuvant eficient al terapiei prin compresie mecanică utilizată în mod curent pentru tratamentul ulcerațiilor varicoase ale membrului inferior / ulcer varicos / ulcer venos al membrului inferior (UVMI).
Cu toate acestea, eficiența terapeutică a dozelor mici de aspirină (150 mg) ca tratament adjuvant al UVMI nu fusese încă studiată și publicată în literatură.
De aceea, în condițiile existenței unui mecanism biologic de acțiune plauzibil, datorat efectului anticoagulant al aspirinei, autorii articolului citat și-au propus să testeze ipoteza existenței unei eficiențe terapeutice și în cazul dozelor mici de aspirină (150 mg), ca posibil tratament adjuvant al UVMI.
Scenariul studiului
S-a realizat un trial clinic randomizat, controlat placebo, orb, cu grupuri paralele, pentru verificarea eficienței terapeutice în favorizarea vindecării ulcerului varicos al membrului inferior, a dozei de 150 mg/zi de aspirină administrată per os (pe cale orală), timp de 24 de săptămâni, în prezența unei terapii de fond prin compresie mecanică.
Vindecarea ulcerului varicos a fost definită în studiu ca existența unei reepitelizări complete a ulcerației de referință (ulcerația cu diametrul inițial cel mai mare, în cazul fiecărui pacient).
Au fost incluşi în studiu 251 de pacienți adulți cu ulcer varicos al membrului inferior în diferite stadii din 5 centre de îngrijire comunitară din Noua Zeelandă (Auckland, South Auckland, Waikato, Christchurch, şi Dunedin): 125 au fost randomizați în lotul experimental (tratat cu aspirină + compresie mecanică) și 126 în lotul de control (tratat placebo + compresie mecanică).
Randomizarea a fost stratificată după centrul de îngrijire și un indice prognostic de vindecare a ulcerului varicos prin compresie simplă, fără asociere medicamentoasă. Participanţii, asistentele care au inclus pacienţii în studiu, investigatorii, persoana responsabilă cu codificarea şi statisticianul au fost mascaţi în ceea ce priveşte alocare tratamentului.
Studiul a comparat reducerea medie a suprafeței ulcerației de referință (măsurată în mm2), precum și proporția (frecvența) vindecării ulcerului varicos în lotul experimental față de lotul de control, după 24 de săptămâni de tratament. Pacienţii au fost analizaţi în loturile în care au fost alocaţi la începutul studiului.
3. Protocolul studiului
1. Scopul, obiectivele şi ipotezele cercetării
Scopul studiului
Evaluarea eficienței terapeutice a dozei de 150 mg/zi de aspirină administrată per os timp de 24 de săptămâni în vindecarea ulcerului varicos al membrului inferior (UVMI), ca tratament asociat compresie mecanice a membrului inferior.
Obiectivele studiului
- Evaluarea existenţei efectului aspirinei comparativ cu placebo.
- Cuantificarea importantei acestui efect, dacă el există.
- Evaluarea cauzalității, dacă se dovedește existența unui efect important din punct de vedere clinic
Ipotezele statistice
Ipoteze privind reducerea suprafeței ulcerației de referinţă
H0: Nu există diferențe semnificative statistic între reducerea medie a suprafeței ulcerației de referintă în lotul experimental (tratat cu aspirină) față de lotul de control (placebo).
H1: Există diferențe semnificative statistic între reducerea medie a suprafeței ulcerației de referintă în lotul experimental (tratat cu aspirină) față de lotul de control (placebo).
Ipoteze privind proporția vindecării ulcerului varicos
H0: Nu există diferențe semnificative statistic între proporția vindecării ulcerului varicos în lotul experimental (tratat cu aspirină) față de lotul de control (placebo).
H1: Există diferențe semnificative statistic între proporția vindecării ulcerului varicos în lotul experimental (tratat cu aspirină) față de lotul de control (placebo).
2. Domeniul cercetării: Evaluarea unei abordări / atitudini terapeutice.
3.Tipul studiului:
- În funcţie de obiectivele studiului:
- Analitic (se fac teste, analize, comparaţii, se caută legături, asocieri);
- În funcţie de rezultatele vizate / intervenția cercetătorului asupra subiecţilor şi evoluţiei bolii studiate):
- Experimental (cercetătorul intervine în mod controlat asupra cursului natural al ulcerațiilor varicoase; administrarea aspirinei);
- În funcţie de design:
- Cu grupuri paralele (fiecare subiect e alocat unui singur grup, pe toată durata studiului: aspirină sau placebo);
- În funcţie de obiectivul trialului:
- Trial de eficiență terapeutică / trial pragmatic (trial realizat în condiţii asemănătoare cu cele din viața curentă, incluzând eventualele probleme de complianță la tratament a pacienților);
- În funcţie de ipoteză clinică:
- Trial de superioritate (ipoteza trialului este că aspirina e superioară față de placebo);
- În funcţie de faza de dezvoltare a medicamentului:
- Trial de Faza IV (Faza de farmacovigilenţa / postmarketing – după lansarea (aprobarea) pe piaţă a medicamentului. Se evaluează alte beneficii ale aspirinei, medicament aprobat şi existent pe piaţă.).
Observație: Dacă evaluarea eficienței terapeutice s-ar fi realizat în scopul obținerii aprobării de comercializare a unui medicament nou, ar fi fost tot un studiu pentru verificarea eficienței terapeutice, însă trialul ar fi fost de fază II sau III.
- În funcţie de metodele utilizate pentru asigurarea validității studiului prin evitarea erorilor sistematice (bias) și a factorilor de confuzie (confounders):
- Trial randomizat: subiecţilor le-au fost alocate la întâmplare (aleator/randomizat) cele două tratamente comparate (aspirină/placebo).
- Trial cu alocare mascată („allocation concealed” - cel care a introdus subiecţii în studiu nu a știut ce intervenţie va primi pacientul);
- Trial în intenție de a trata: toţi pacienţii au fost analizaţi în grupurile în care au fost randomizaţi (analiza a fost de tipul “intenţie de a trata” („intention to treat analysis” – indiferent dacă au primit aspirină sau placebo, chiar dacă nu au luat tot tratamentul, sau dacă l-au luat discontinuu, pacienții au fost analizaţi ca şi cum ar fi luat tratamentul în mod corect);
- Trial triplu orb: a fost folosită metoda orb (blind/masking/mascare) în varianta triplu orb (nici pacientul, nici investigatorul care a evaluat rezultatele intervenției, nici persoana însărcinată cu codarea şi nici statisticianul nu au știut dacă pacientul a primit aspirină sau placebo);
- Trialul a fost controlat (tratamentul evaluat a fost comparat cu placebo).
4. Populaţia ţintă şi eşantionul de studiu
Populaţia ţintă
- Caracteristici clinice (ex. boala, stadiul bolii, complicaţii, stare funcţională): Pacienți cu ulcer varicos al membrului inferior, în diferite stadii;
- Caracteristici demografice (restricţii pe anumite vârste, sex, status socioeconomic, regiuni geografice): Pacienți adulți (cu vârsta peste 18 ani) din Noua Zeelandă.
Populaţia accesibilă
Pacienți adulți din 5 centre de îngrijire comunitară din Noua Zeelandă (Auckland, South Auckland, Waikato, Christchurch, şi Dunedin).
Eşantionul de studiu
Criterii de includere
Pacienți adulți care puteau tolera terapia prin compresia membrului inferior cu ciorapi elastici de compresie, capabili să ofere consimțământ informat de participare în studiu, a căror medic de familie a confirmat că pot fi tratați cu aspirină sau placebo, și care aveau un diagnostic confirmat de ulcer varicos al membrului inferior (conform unei definiții de caz bine precizate și prezentate în articol).
Criterii de excludere
Au fost excluse din studiu persoanele însărcinate sau care alăptau, cele cu antecedente de infarct miocardic, accident vascular cerebral, atac ischemic tranzitor, angina pectorală, boală arterială periferică majoră, pacienții cu un istoric de reacții adverse legate de utilizarea aspirinei (hipersensibilitate, alergie, astm indus de aspirină sau alte medicamente antiinflamatoare nesteroidiene), pacienții care utilizau deja aspirină sau alt tratament anticoagulant; pacienții cu afecțiuni sau tratamente coexistente care indicau, sau, dimpotrivă, contraindicau utilizarea aspirinei, precum și pacienții considerați, din orice alt motiv, ca neputând participa în mod sigur la acest trial clinic, sau care nu și-au oferit consimțământul informat de participare la studiu.
Talia (mărimea) eşantionului:
Cercetătorii au calculat o talie minim necesară de 318 participanți, pentru a putea pune în evidență o ameliorare cu cel puțin 15% a ratei de vindecare în prezența tratamentului adjuvant cu aspirină, estimată din studii anterioare, cu un risc de eroare de tip I de α=0,05, și o putere a studiului de cel puțin 90%. Pentru atingerea, în aceleași condiții, a unei puteri minim acceptabile de 80%, talia calculată de către cercetători a fost de 238 de participanți.
5. Modalitatea de culegere a datelor
- În funcţie de populaţia cuprinsă în studiu: Prin eşantionare (se studiază o parte din toată populaţia ţintă) ;
- În funcţie de durata culegerii datelor: Longitudinală, prospectivă (se culeg informaţii urmărind subiecţii în timp: la intrarea în studiu şi apoi după un interval de timp, pentru a înregistra evoluţia UVMI);
- În funcţie de modul de alcătuire a grupului / grupelor de subiecţi luaţi în studiu: Eşantion reprezentativ (se studiază un eșantion de pacienți cu aceleași caracteristici / criterii de includere, care copiază fidel caracteristicile populaţiei din care a fost extras. Acest eșantion reprezentativ a fost apoi randomizat în mod mascat, dând naștere celor două grupuri comparate: grupul/lotul experimental, tratat cu aspirină și grupul/lotul de control, tratat cu placebo).
6. Definirea efectului studiat și a variabilelor asociate
Efectele studiate:
Principalele efecte studiate au inclus: modificarea suprafeței ulcerate și proporția participanților vindecați.
Studiul a urmărit și alte efecte, ce nu vor constitui însă obiectul scenariului de studiu propus dumneavoastră spre rezolvare: timpul scurs până la vindecare (evaluarea eficienței terapeutice prin analiză de supraviețuire), modificarea calității vieții pacienților, și apariția unor efecte adverse. În plus, studiul a analizat și eficiența alocării mascate a tratamentului și a urmărit controlul efectului unor factori de confuzie cunoscuți, prin analize multivariate de ajustare.
Variabilele studiate (sunt menționate numai variabilele relevante scenariului de studiu propus spre rezolvare)
Variabile calitative (atribut): sexul participantului, tipul tratamentului, prezența vindecării după 24 de săptămâni.
Variabile cantitative: suprafața ulcerației de referință inițială și finală (mm2), reducerea suprafeței ulcerației de referință (mm2).
7. Planul de descriere şi analiză a datelor (sunt menționate numai metodele de descriere și analiză a efectelor și variabilelor urmărite și în scenariul de studiu propus spre rezolvare)
Planul de descriere a datelor
- Pentru variabile calitative: tabele de frecvență;
- Pentru variabile cantitative: statistici descriptive de centralitate și de dispersie, prezentate în mod tabelar;
Observație: Autorii studiului au preferat să nu utilizeze reprezentări grafice pentru descrierea variabilelor calitative și cantitative, însă, planul / protocolul studiului dumneavoastră poate cuprinde și metode grafice de descriere a variabilelor studiate, dacă le veți considera utile pentru redactarea rezultatelor descriptive.
Planul de analiză a datelor
Analiza prin tabele sau figuri a relaţiei dintre variabile:
- Autorii studiului nu au utilizat grafice de medie sau box-plot ale variabilelor cantitative în grupurile comparate, tabele de contingență sau reprezentări grafice ale frecvențelor de vindecare observate în studiu, însă, planul studiului dumneavoastră poate cuprinde și asemenea metode grafice / tabelare de evaluare preliminară și ilustrare a relaţiei dintre variabilele studiate.
Analiza statistică în funcție de obiectivele acesteia:
- Studierea comparabilităţii eşantioanelor rezultate în urma randomizării: verificată prin compararea caracteristicilor inițiale ale pacienților din cele două loturi (vedeți în articol: Tabelul 1. Baseline characteristics for trial participants).
- Evaluarea existenţei efectului terapeutic
- Testul t-Student pentru eșantioane independente - pentru compararea reducerii medii a suprafeței ulcerației de referintă în lotul experimental față de lotul de control (presupunând existența unei distribuții normale a variabilei de interes în populația țintă).
- Testul Chi pătrat (χ2) - pentru compararea proporției participanților vindecați din cele două loturi studiate;
- Cuantificarea eficienței terapeutice (numai dacă la obiectivul anterior se poate dovedi existența unui efect terapeutic semnificativ al aspirinei 150 mg/zi în tratamentul adjuvant al ulcerului varicos)
- Estimatorii punctuali şi intervalele de încredere (95% CI) ale unor indicatori medicali de cuantificare a eficienței terapeutice:
- Riscul relativ (Relative Risk sau Risk Ratio): RR=REE/REC
- Reducerea abolută a riscului (Absolute Risk Reduction): ARR=|REE-REC|
- Numărul necesar pentru a trata (Number Needed to Treat): NNT=1/ARR
Instrumente de analiză utilizate: versiunea 9.4 a programului SAS (Statistical Analysis System).
Rezultate obținute în studiu. Analiza datelor și prezentarea lor
În urma aplicării criteriilor de includere și excludere impuse în planul de studiu, din 1563 potențiali participanți evaluați, doar 251 au putut fi incluși în studiu și randomizați în cele două loturi studiate (vezi figura 1 din articol).
Grupurile randomizate s-au dovedit a avea caracteristici comparabile, cu excepția unor diferențe în privința vârstei și a proporției participanților aflați la primul episod de ulcer varicos vs. cei cu ulcer recidivant.
Rata de urmărire în studiu (follow-up) a fost de 100% pentru efectul principal urmărit.
Reducerea suprafeței ulcerate față de valoarea inițială a fost de 4,1 cm2 în grupul tratat cu aspirină și de 4,8 cm2 în grupul tratat cu placebo (p=0,25). Astfel, diferența medie între grupuri a fost de -0,7 cm2 (95% CI -1,9 cm2 – 0,5 cm2).
Proporția participanților complet vindecați după 24 de săptămâni a fost mai mică în grupul tratat cu aspirină (70,4%, adică 88 de subiecți) vs. 80,2%, adică 101 subiecți în grupul placebo. Această diferență nu a fost semnificativă statistic (χ2=1,53, p=0,22).
În urma identificării rezultatelor de mai sus din articol, putem să construim tabelul de contingență corespunzător situației descrise de autori, chiar și în lipsa publicării acestui tabel în articol:
Tabelul 1. Distribuția vindecării ulcerului varicos în lotul experimental comparativ cu lotul de control
| Vindecarea ulcerului varicos | Absenţa vindecării ulcerului varicos | Total | |
| Aspirina | 88 | 37 | 125 |
| Placebo | 101 | 25 | 126 |
| Total> | 189 | 62 | 251 |
Pe baza acestui tabel de contingență putem calcula estimatorii punctuali ai indicatorilor medicali de cuantificare a eficienței terapeutice. Pentru aceasta calculăm următorii indicatori de eficiență terapeutică:
- RR=REE/REC=(88/125)/(101/126)=0,704/0,802=0,878
- RAR=|REE-REC|=0,098
- NNT=1/RAR=1/0,1=10
Observații:
- Acești indicatori nu au fost calculați și prezentați în articol, întrucât eficiența terapeutică a dozelor mici de aspirină (150 mg/zi) nu a putut fi dovedită.
- Determinarea indicatorilor de mai sus reprezintă doar o exemplificare a modului de calcul al estimatorilor punctuali ai celor mai frecvent utilizați indicatori ai eficienței terapeutice. Acești indicatori medicali sunt utilizați pentru cuantificarea eficienței terapeutice în studiile care reușesc să dovedească existența eficienței terapeutice în etapa de testare a ipotezei studiate.
- Întrucât reducerea absolută a riscului (ARR) se calculează în valoare absolută, dacă am fi calculat numărul necesar pentru a trata (NNT) în acest studiu, am fi cuantificat de fapt un beneficiu aparent al tratamentului de control (placebo) față de tratamentul evaluat. Acest aparent beneficiu a apărut însă întâmplător, fiind nesemnificativ statistic.
Interpretarea rezultatelor. Discuții
Întrucât în acest studiu valorile lui p>0,05 (p=0,25 – test Student; p=0,22 – test χ2), dovezile rezultate din acest studiu au fost insuficiente pentru a respinge ipotezele nule ale acestuia. Prin urmare, diferențele dintre grupul tratat prin compresie mecanică+aspirină 150 mg/zi și cel tratat prin compresie mecanică+placebo nu au fost semnificative statistic.
Așadar, la persoane cu ulcere varicoase ale membrelor inferioare tratate prin compresie mecanică a membrului afectat, tratamentul cu doze mici de aspirină (150 mg/zi) timp de 24 de săptămâni nu a crescut procentul participanților cu ulcere varicoase vindecate și nu a îmbunătățit reducerea suprafeței ulcerate.
În ceea ce privește interpretarea indicatorilor medicali de cuantificare a eficienței terapeutice, întrucât dozele mici de aspirină (150 mg/zi) nu și-au demonstrat eficiența terapeutică față de placebo, cuantificarea acestei eficiențe prin indicatori medicali și interpretarea acestora nu ar fi avut sens în acest studiu.
Cu toate acestea, pentru exemplificare, formulăm mai jos principalele interpretări ale indicatorilor medicali calculați mai sus, în baza tabelului de contingență pe care ni l-am creat după extragerea frecvențelor relevante din studiu:
- Riscul Relativ: RR=REE/REC=0,878
După cum știm deja, un risc relativ, RR 1 indică un factor de protecție pentru apariția evenimentului studiat (vindecarea).
Cum acest studiu a fost însă și el unul negativ, în care frecvența vindecării a fost mai mare în lotul placebo decât în lotul tratat cu aspirină (o diferență apărută însă din întâmplare, ea nefiind semnificativă statistic !), dacă am calcula și interpreta estimatorul punctual al RR acesta ne-ar arăta că:
- în eșantionul studiat, proporția subiecților tratați cu aspirină și care s-au vindecat a fost de 1,4 (1/0,878) ori mai mică decât proporția subiecților tratați cu placebo care -au vindecat.
Efectul terapeutic cuantificat, fiind însă unul nesemnificativ statistic, dacă ar fi să calculăm intervalul de încredere asociat estimatorului punctual al RR în acest caz, acest interval ar include valoarea neutră a unei rații, adică 1, confirmând astfel lipsa de semnificație statistică a RR în acest studiu.
- Reducerea absolută a riscului:
RAR (ARR)=|REE-REC|=0,1=10% (95%CI -1% ; 20%)
Din motivele prezentate mai sus, reducerea absolută a riscului (ARR=absolute risk reduction), dacă ar fi calculată după formula și cu intervalul de încredere de mai sus, ne-ar arăta că:
- în eșantionul studiat, rata absenței vindecării în lotul tratat cu aspirină a fost cu 10% mai mare decât rata absenței vindecării în lotul placebo.
- în 95% din populația țintă, ne putem aștepta ca rata absenței vindecării în lotul tratat cu aspirină să varieze de la o valoare cu 1% mai mică decât în lotul placebo, la o valoare cu 20% mai mare decât în lotul placebo.
- și pentru acest indicator medical (ARR), intervalul de încredere asociat estimatorului punctual al acestuia include valoarea neutră, (care este 0% în cazul unui indicator rezultat în urma unei diferențe de risc), ceea ce denotă lipsa semnificației statistice a acestei reduceri de risc privind evenimentul studiat (în acest caz, absența vindecării).
- Numărul necesar pentru a trata (pentru a avea un beneficiu):
NNT=1/RAR=1/0,1=10
Amintindu-ne din nou că acest studiu este unul negativ (ipoteza nulă privind lipsa eficienței terapeutice a aspirinei 150mg/zi nu a putut fi respinsă), și în plus, frecvența vindecării fiind mai mare în lotul placebo decât în lotul tratat cu aspirină (diferență nesemnificativă statistic, însă !), dacă am calcula și interpreta estimatorul punctual al NNT=10, acesta ne-ar arăta că:
- în eșantionul studiat, la fiecare 10 pacienți tratați, un pacient în plus s-a vindecat din lotul placebo față de lotul tratat cu aspirină.
Observații:
- Un tratament ideal are NNT=1, adică fiecare pacient tratat din lotul experimental va avea un beneficiu în urma tratamentului, sau va evita un eveniment negativ (e.g. decesul, agravarea bolii, absența vindecării), în timp ce nici un pacient din lotul de control nu va avea un asemenea beneficiu (sau nu va evita un eveniment de sănătate negativ).
- În funcție de tipul patologiei tratate și de gravitatea evenimentului evitat prin tratament, NNT este de obicei considerat important clinic atunci când valoarea sa est apropiată de 1, uneori însă, chiar și valori mai mari, de 3-5 sau chiar >10 pacienți pot fi considerate importante clinic, în special în situațiile când evenimentul evitat este unul foarte grav (e.g. decesul) sau în lipsa unor alternative terapeutice mai eficiente, bineînțeles, cu condiția să fi fost dovedită în prealabil semnificația statistică a eficienței terapeutice.
- Dacă sunt concepute cu o putere suficient de mare pentru a pune în evidență și efecte de mărime redusă, și dacă sunt conduse în mod corect și riguros, trialurile negative (cele care nu reușesc să dovedească eficiența terapeutică a unui medicament evaluat) pot aduce informații la fel de valoroase ca cele rezultate din trialurile pozitive (cele care reușesc să dovedească eficiența terapeutică a medicamentului evaluat).
Concluzia studiului
Rezultatele acestui studiu nu susțin utilizarea aspirinei în doze mici (150 mg/zi), ca tratament adjuvant al terapiei prin compresie mecanică în ulcerele varicoase ale membrului inferior.
Pentru indicații de rezolvare accesați fișierele Indicații , EpiInfo7 și Interpretări.
Legături utile 2-way Contingency Table Analysis - OpenEpi 2x2 Table Statistics
Cercetarea factorilor implicați în patogeneză prin studii caz-martor
O categorie importantă de studiile clinice este aceea care evaluează relaţia dintre unul sau mai mulți factori prognostici şi diverse stări patologice. În aceste studii, se evalueză sau legătura între factor/factori şi apariţia unei boli sau dacă un anumit factor modifică evoluţia unei boli (ameliorare sau vindecare).
Factorii prognostici pot fi: factori de risc (favorizează apariţia unei boli) sau factori protectivi (previn aparţia bolii sau ajută la vindecare).
Investigarea relației dintre posibilii factori prognostici și boală se poate realiza prin toate tipurile de culegere de date fără ca cercetătorul să intervină.
În studiul de tip caz-martor se pornește de la faptul că afecțiunea este rară și se identifică întâi cazurile: subiecți care au o anumită boală și apoi se aleg martorii: subiecți cu caracteristici similare (gen, vârstă, status socio-economic) dar care nu au boala. Numai după aceea se caută prin metode retrospective sau transversale existența factorilor prognostici la aceste grupuri. Dintre metodele de identificare a factorilor prognostici se pot enumera: determinări de laborator, chestionar standardizat, interviu cu subiectul/membrii familiei acestuia sau consultarea foilor de observaţie ale subiecților înscriși în studiu.
Puncte forte ale studiului caz-martor:
- eficiente în cazul bolilor rare sau bolilor cu perioadă mare de latență
- relativ uşor de realizat (puţin costisitoare, iau puţin timp)
- permit analiza mai multor factori prognostici
Puncte slabe ale studiului caz-martor:
- pot aduce informaţii eronate (ex. subiecţii uită anumite expuneri, sau subiecţii bolnavi au tendinţa să-şi aducă aminte mai bine expuneri chiar nesemnificative faţă de persoanele sănătoase)
- timpul scurs între momentul de debut al expunerii și apariția bolii poate fi dificil de determinat
Exemplu de studiu caz-martor
Un exemplu de studiu caz-martor este cel realizat de autorii Destaalem Gebremedhin, Haftu Berh și Kahsu Gebrekirstos, studiu intitulat „Risk Factors for Neonatal Sepsis in Public Hospitals of Mekelle City, North Ethiopia,2015: Unmatched Case Control Study”, publicat în anul 2016, revista PLOS ONE (ISI, IF:2.80, Q1).
Sursa articolului:
http://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0154798&type=printable
Definiţii utilizate ȋn studiu
Sepsisul (septicemia) neonatal – sindrom de răspuns inflamator sistemic în prezența sau ca urmare a unei infecții dovedită sau suspectată la un nou-născut. Infecția ar putea fi de tip bacterian, viral, fungic.
Scenariul studiului- exemplu
Gebremedhin D et al. au realizat un studiu asupra nou-născuţilor înregistrați la spitalele publice din Mekelle, Ethiopia de Nord, perioada Decembrie 2014 - Iunie 2015, pentru identificarea factorilor de risc ai sepsisului neonatal.
Datele necesare studiului au fost culese din fișele medicale ale nou-născuților și cu ajutorul unui chestionar semi-structurat aplicat mamelor.
În cadrul studiului au fost alcătuite două loturi de subiecţi: un lot de 78 de nou născuţi diagnosticați cu sepsis neonatal şi un lot martor (156 nou-născuți fără sepsis).
Criteriile de includere pentru cazuri au fost:
- nou-nascutii înregistrați în secțiile de pediatrie sau terapie intensivă neonatală a spitalelor publice din Mekelle City, Etiopia de Nord, în timpul perioadei de studiu cu cel puțin una din urmatoarele caracteristici clinice IMNCI (Integrated Management of Neonatal and Childhood Illness): febră (≥37,5 °C) sau hipotermie (≤ 35,5 °C), respirație rapidă (≥ 60 respirații pe minut), indigestie toracică severă, , mișcări numai atunci când sunt stimulate, convulsii, letargice sau inconștiente
- și cel puțin 2 criterii hematologice: numărul de leucocite total (12000 celule/m3, numărul absolut de neutrofile (7500 celule mm3), rata de sedimentare a eritrocitelor (>15/1h), numărul de trombocite > 440 celule/m3)
Criteriile de includere pentru martori au fost:
- Nou-născuții care nu au îndeplinit criteriile de sepsis si care au fost înregistrați la secțiile de pediatrie sau de terapie intensivă neonatală a spitalelor publice din Mekelle, Etiopia de Nord, în timpul perioadei de studiu
Protocolul studiului
1. Scop și obiective
Scopul acestui studiu a fost evaluarea asocierii dintre antecedentele mamei de infectie urinară sau infecție cu transmitere sexuală și sepsisul neonatal.
Obiective:
• Testarea existenţei legăturii dintre factor (ruptura prelungită a meembranei) și boală (sepsis neonatal):
• Studiul mărimii efectului (cuantificarea importanței legăturii): estimarea indicatorului rata șansei (engl. odds ratio: OR)
2. Domeniul de cercetare: factori de risc şi/sau prognostici.
3. Tipul studiului:
• ȋn funcţie de obiectivele studiului: studiu analitic
• ȋn funcţie de rezultatele vizate: studiu observațional
• ȋn funcţie de tehnica utilizată în alegerea grupurilor: fără potrivire (engl. unmatched)
Notă:
studiu analitic= se compară grupuri de pacienţi, se testează asocieri între diverse caracteristici clinice în timp ce ȋntr-un studiu descriptiv se descrie o serie de cazuri sau un singur grup de pacienţi și nu se investighează posibile asocieri/legături
studiul observațional= acel tip de studiu care nu presupune o intervenţie a cercetătorului asupra evoluţiei bolii.
potrivire (matching) în cazul studiilor în care se compară grupuri= pentru fiecare subiect din grupul caz/expus se găsește un subiect cu caracteristici similare pentru grupul de comparație (control/neexpus). Ex. Potrivire făcută după: același sex, vârstă similară (identic sau +/- 2 ani), aceiași factori de risc (ex. diabetici). Potriviea poate fi făcută 1:1 sau 1:2, 1:3, 1:4 (adică un caz la 1/2/3/4 martori).
4. Populaţia accesibila şi eşantionul de studiu
Populaţia accesibilă
Nou-născuți veniţi pe lume în secţiile de obstetrică ale spitalelor publice din din Mekelle, Etiopia de Nord, perioada: Decembrie 2014 - Iunie 2015.
Eşantionul de studiu
Criterii de includere
Au fost selectatați nou-născuți veniți pe lume în perioada Decembrie 2014 - Iunie 2015, în secțiile de obstretică ale spitalelor publice din din Mekelle, Etiopia de Nord.
Criterii de excludere
Notă: ȋn acest scenariu propus nu sunt menţionate criteriile de excludere.
Talia (mărimea) eşantionului
Autorii menţionează ȋn articol că talia eșantionului a fost estimată la 234 subiecți pentru o eroare de speța a doua de 0.20 ( deci o putere a studiului de 80%), o proporție a antecedentelor AIU/AIS cu nou-născuți fără sepsis de 13% (determinată într-un alt studiu pe populație similară), raport control/cazuri=2:1, și un OR=2.87. Considerăm că talia eşantionului a fost suficientă.
5. Modalitatea de culegere a datelor
în funcţie de populaţia cuprinsă în studiu: eșantionare aleatoare sistematică-vezi secțiunea de Metodă a articolului.
în funcţie de durata culegerii datelor: longitudinală retrospectivă.
în funcţie de modul de alcătuire a grupului sau grupelor de subiecţi: caz-martor (cele două grupuri au fost definite în funcție de prezența/absența sepsisului neonatal).
Nota: Tipuri de eșantionare probabilistică
- Eșantionare aleatoare simplă: fiecare element din cadrul populației are aceeași șansă de a fi inclus în esation
- Eșantionare aleatoare sistematică: presupune alegerea aleatoare a unui număr de plecare (pas), de la care, adaugând o mărime fixă va rezulta o unitate (element) a eșantionului
- Eșantionare aleatoare stratificată: constă în împărțirea populației de cercetare în straturi, în funcție de anumite caracteristici (gen, grupe de vârstă) pentru ca din fiecare strat să se extragă aleator subeșantioane (grupuri) proporționale cu mărimea stratului respectiv, grupuri care sunt apoi combinate pentru a obţine un singur eşantion
- Eșantionare aleatoare pe grupuri (cluster): Populația de cercetare este împărţită pe grupuri (clusters) și un număr de grupuri sunt selectate aleatoriu cu toate unitățile (elementele) incluse
6. Analiza statistică
Caracteristici demografice și clinice ale mamei
Vârsta: variabilă cantitativă continuă
Nivel educațional (Scoala primară, secundară, colegiu sau facultate): variabilă calitativă ordinală,
Antecedente de infecție urinară sau infecție cu transmitere sexuală (AIU/AIS), Tulburări de hipertensiune, Mediul de proveniență, ruptură prelungită a membranei, febră intrapartum: variabile calitative dichotomiale
Stare civilă, Religie, etnie,Ocupație: variabile calitative nominale
Caracteristici demografice și clinice nou-născut:
Gen nou-nascut (M/F), Scor Apgar_1minut (7 codificat cu 1 versus ≥7 codificat cu 0; Scor Apgar_5minute (7 codificat cu 1 versus ≥7 codificat cu 0), Resuscitare la nastere (da;nu), Sepsis (da,nu),: variabile calitative dichotomiale
Greutate la naștere (1500-2500 grame; ≥2500 grame), Vârsta gestațională (42 saptamani): variabile calitative ordinale
Descrierea datelor: Se poate realiza fie printr-un tabel de frecvenţă, tabel de contigenţă, sau grafic de tip coloane verticale sau orizontale.
Asocierea bivariată dintre factorul de expunere și boală se va demonstra prin teste statistice de tip Hi-pătrat sau testul exact al lui Fisher (ultimul se aplică dacă cel puțin 20% dintre frecventele din tabelul de contingenţă teoretic5).
Asocierea multivariată dintre factorul de expunere si boală: prin regresia logistică multivariată.
Pentru cuantificarea importanței asocierii dintre factorul de expunere și boală se va calcula raportul șansei (OR) de sepsis și intervalul de încredere de 95% (IC) asociat.
- Dacă raportul șansei estimat OR>1 si ambele capete (limita inferioară și limita superioară) ale intervalului de incredere sunt mai mari decat 1 atunci se poate afirma ca factorul de expunere este un factor de risc.
- Dacă raportul șansei estimat OR 1 si ambele capete (limita inferioară și limita superioară) ale intervalului de incredere sunt mai mici decat 1 atunci se poate afirma ca factorul de expunere este un factor protector.
- Dacă raportul șansei estimat OR=1 sau intervalul de încredere conține pe 1 atunci se poate afirma că nu avem suficiente dovezi pentru a demontra că factorul de expunere este factor de risc sau protector.
Notă: raportul șansei se poate determina în forma neajustată (denumită și „crude odds ratio”) reprezentand șansa de boală la pacienții expuși versus non-expuși și/sau în forma ajustată (denumit și „adjusted odds ratio”) reprezentând șansa de boală la la pacienții expuși versus non-expuși ajustat dupa prezența altor covariate.
Rezultate scontate. Analiza datelor și prezentarea lor
1. Descrierea eșantionului
În prezentul studiu, descrierea caracteristicilor măsurate pe eșantion s-a realizat cu ajutorul tabelelor contingență prezentate într-o formă condensată în secțiunea de Rezultate a articolului.
Tabel 1. Descrierea caracteristicilor socio-demografice pe grupurile de studiu
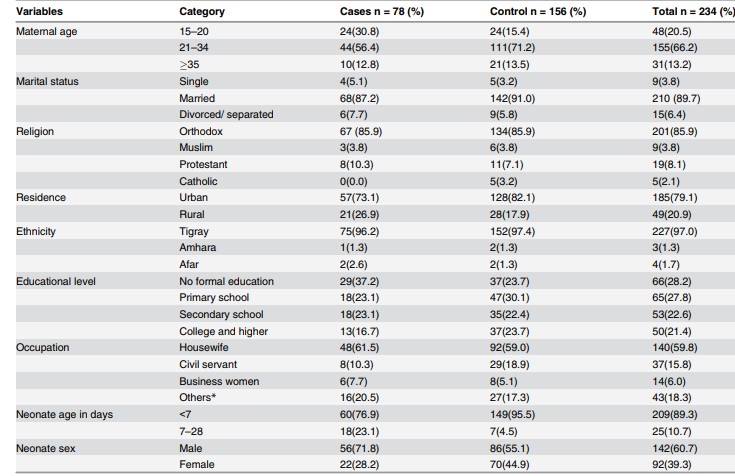
Sursa: imagine preluată din articolul Gebremedhin D, Berhe H, Gebrekirstos K. Risk Factors for Neonatal Sepsis in Public Hospitals of Mekelle City, North Ethiopia, 2015: Unmatched Case Control Study. PLoS One. 2016 May 10;11(5):e0154798.
2. Asocierea bivariată și multivariată între antecedentele de infecție urinară sau infecție cu transmitere sexuală și sepsis neonatal.
Tabelul de contingenţă dintre factorul de risc (AIU/AIS) şi boală (sepsis):
|
Sepsis(da) |
Sepsis (nu) |
Total |
|
|
AIU/AIS (da) |
40 |
21 |
61 |
|
AIU/AIS(nu) |
38 |
135 |
173 |
|
Total |
78 |
156 |
234 |
|
AIU/AIS= antecedentele mamei de infecție urinară sau infecție cu transmitere sexuală |
|||
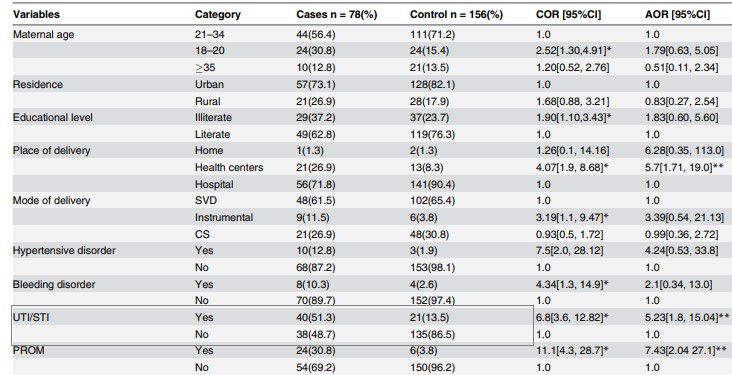
Tabel 2. Asocierea bivariată și multivariată dintre AIU/AIS și sepsisul neonatal. Sursa: preluat din articolul Gebremedhin D, Berhe H, Gebrekirstos K. Risk Factors for Neonatal Sepsis in Public Hospitals of Mekelle City, North Ethiopia, 2015: Unmatched Case Control Study. PLoS One. 2016 May 10;11(5):e0154798.
Grafic tip coloane pentru relatia dintre factorul de risc şi boală (realizat în Excel):
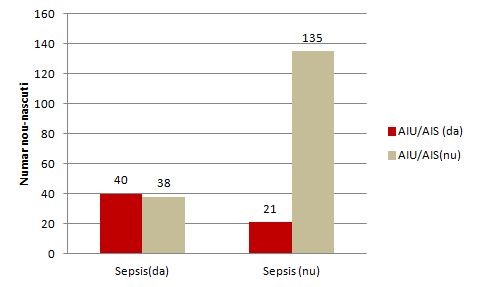
Figura 1. Relatia dintre antecedentele mamei AIU/AIS si sepsisul neonatal
Raportul şansei (OR neajustat) și intervalul de încredere asociat (Tabelul 2; pentru calculul estimatorului punctual și a intervalul de incredere asociat se poate utiliza programul EpiInfo; formatul de scriere a rezultatului: estimator puncual (95% Ci: limită inferioară-limită superioară):
OR=6,8 (95% CI: 3,6-12,8)
Valoarea lui p (realizat in EpiInfo; se raportează ca p=valoare - numele testului folosit, cu maxim 3 zecimale, dacă p0.001 atunci se poate scrie ” p0.001”):
p0,001-Test Chi-patrat
Notă: în prezentul studiu, autorii au estimat și rata șansei ajustată în funcție de diferite asocieri precum vârsta mamei, mediul de proveniență, tipul nașterii, ruptura prelungită a membranei, etc.
Interpretarea datelor.
Discuții
1. Interpretarea rezultatelor din punct de vedere statistic
Obiectivul studiului a fost testarea și cuantificarea asocierii dintre antecedentele mamei AIU/AiS și sepsisul neonatal
Din punct de vedere statistic, testarea asocierii s-a realizat prin formularea a două ipoteze (ipoteza nulă și ipoteza alternativă), ipoteza nulă fiind cea testată. În cazul respingerii acesteia, afirmăm că suntem în favoarea ipotezei alternaltive.
Ipoteza nulă: Nu există asociere semnificativă intre antecedentele mamei AIU/AiS și sepsisul neonatal
Ipoteza alternativă: Există asociere semnificativă între antecedentele mamei AIU/AiS și sepsisul neonatal
Deoarece p0,05, există asociere semnificativă între antecedentele mamei AIU/AiS și sepsisul neonatal
Din punct de vedere statistic, cuantificarea asocierii s-a realizat prin estimarea punctuală a indicatorului OR (neajustat și ajustat) și a intervalului de încredere de 95% asociat.
Estimator punctual:
OR=6,8: nou-născuții ai căror mame au avut antecedente AIU/AIS în timpul sarcinii au avut șanse de 6,8 ori mai mari de a dezvolta sepsis comparativ cu nou-născuții ai căror mame nu aveau AIU/AIS.
Interval de încredere pentru OR :
95% IC: 3,6-12,8 –suntem 95% siguri că rata șansei pe populația de studiu se va afla între 3,6 și 12,8 (dacă extragem eșantioane, de aceeași mărime din populația de studiu, 95% dintre IC determinate vor conține rata șansei la populația țintă de nou-născuți).
În plus, OR>1 și ambele capete ale intervalului de incredere au fost mai mari decat 1, deci antecedentele mamei AIU/AIS sunt un factor de risc al sepsisului neonatal.
Notă: în studiul prezentat, autorii au realizat și analiza asocierii dintre AIU/AIS în contextul prezenței și altor covariate (factori maternali și neonatali) precum hipertensiune in sarcină, febră intrapartum, complicații la naștere, scor apgar mic la 5 minute, etc, obtinându-se și un OR ajustat=5.23, 95% IC: 1.8- 15.04. Întrucât rezultatele au fost semnificative statistic, se poate afirma că antecedentele mamei Aiu/AIS rămân un factor de risc independent la sepsisului neonatal.
2. Interpretarea rezultatelor din punct de vedere clinic
Mărimea indicatorului OR în context clinic:
• Foarte importantă/moderat/puțin importantă
OR=6,8 denotă o mărime moderată în contextul în care studiile similare realizate pe aceeași populație au obținut un OR=12.9 (vezi secțiunea Discuții a articolului).
Precizia rezultatului (vezi lărgimea intervalului de încredere):
• Relativ precis/imprecis (interval larg – rezultate imprecise, interval ingust – rezultate precise)
Intervalul de încredere de 95% : 3,6-12,8 poate fi considerat ca un interval relativ precis
• legătură relativ importantă clinic (ambele capete cu valoare clinică importantă)
Legătura dintre factorul maternal (antecedente AIU/AIS în timpul sarcinii) și apariția sepsisului poate fi considerată ca având relevanță clinică și fiind relativ importantă (în simularea taliei eșantionului, autorii considerând o mărime a efectului OR=2,87 ca fiind de interes).
Concluziile studiului
Antecedentele mamei de infecție urinară sau infecție cu transmitere sexuală ca factor maternal contribuie la riscul de sepsis neonatal, fiind chiar un factor de risc independent.
Pe serverul disciplinei în directorul Dvs. realizați un director LAB02. Descărcați fișierul de mai jos în acest director și completați spațiile albe. Salvați fișierul.
Studiul bibliografic
Studiul bibliografic reprezintă studiul literaturii de specialitate prin consultarea articolelor științifice, referatelor, cărților de specialitate și tratatelor despre subiectul pe care vă propuneți să îl cercetați și reprezintă o etapă esențială în pregătirea și construirea unei cercetări precum și în comunicarea rezultatelor acesteia.
După stabilirea ideii de cercetare următoarea etapă este cea de documentare bibliografică. Datele de identificare ale articolelor științifice, referatelor, cărților de specialitate și tratatelor (autori, titlu...) împreună cu notițe și/sau rezumatul articolului constituie o fișa bibliografică. Aceasta vă ajută să regăsiți ușor informații din articolele sau cărțile pe care le-ați găsit a fi de interes, în momentul documentării. Fișele bibliografice sunt folosite pentru a argumenta informațiile prezentate în lucrare prin citarea acestora, precum și pentru a realiza referințele pe care le veți scrie în capitolul „Referințe”, aranjate în ordinea citării lor în textul lucrării.
Documentarea bibliografică se realizează prin accesarea diferitelor surse precum:
- biblioteca personală,
- biblioteca universității,
- bibliotecă electronică a UMF Cluj http://www.umfcluj.ro/educatie-ro/reurseedu-ro/biblioteca-ro,
- reviste de specialitate
- PubMed: http://www.pubmed.gov,
- SpringerLink: http://www.springerlink.com,
- ScienceDirect: http://www.sciencedirect.com,
- The Cochrane Collaboration: http://www.cochranelibrary.com,
- Dentistry and Oral Sciences (DOSS) https://health.ebsco.com/products/dentistry-oral-sciences-source,
- EMBASE: http://www.embase.com, etc.
PubMed (https://www.ncbi.nlm.nih.gov/pubmed), baza de date a Bibliotecii Naționale de Medicină a Statelor Unite ale Americii, este o resursă gratuită care oferă acces la MEDLINE, a citărilor și rezumatelor din domeniile medicină (generală, dentară, veterinară), asistență medicală, și științele vieții. PubMed permite căutarea articolelor de specialitate oferind acces la rezumat, iar pentru unele articole oferă acces către forma integrală sau link către publicație. Termenii de căutare utilizați de PubMed sunt cei ai vocabularului standard MeSH (MESH-Medical Subject Headings). Pentru mai multe detalii cu privire la MeSH puteți accesa resursa de la adresa: https://www.nlm.nih.gov/bsd/disted/video.
O căutare PubMed permite identificarea următoarele informații:
- Titlul articolului
- Numele autorilor
- Abrevierea revistei, anul publicării, volumul, numărul și numărul de pagini
- Limba în care articolul a fost publicat (dacă nu este limba engleză)
- Căutarea în PubMed permite impunerea anumitor restricții cu privire la:
- Tipul articolului (recenzie, scrisoare către editor, articol original, trial clinic, etc.)
- Tipul accesului (rezumat / text integral – link către jurnalul în care articolul a fost publicat / text integral gratuit – acces la articole Open Access)
- Perioada căutării
- Specia (subiecți umani / animale)
- Alte filtre adiționale (limba în care a fost publicat articolul, criterii demografice: vârstă, gen).
Citarea referințelor în stilul Vancouver
În cazul în care în textele dumneavoastră utilizați informații sau preluați integral sau parțial text al unei resurse trebuie specificați clar acest lucru. Prin utilizarea referinței dați credit autorului și vă apărați de posibilele acuzații de plagiat sau cu privire la veridicitatea sau exactitatea informațiilor respective. Referința va face legătura dintre textul dumneavoastră și sursa originală a informațiilor.
Stilul de citare a referințelor în domeniul medical este Vancouver.
Utilizarea acestuia presupune:
• semnalizarea în text prin inserarea unui număr între paranteze drepte a faptului că se utilizează o referință. Aceste numere vor fi în ordine crescătoare, pornind de la începutul documentului.
• existența la sfârșitul documentului a listei numerotate, conținând detaliile surselor citate în text. Aceste detalii vor fi redactate într-un format standard, specific fiecărui tip de document citat (articol publicat într-o revistă tipărită, articol publicat pe internet, carte, capitol de carte, etc.)

Exemplu de citare în stil Vancouver
Formatarea listei de referințe - semnele de punctuație, separatorii dintre entități, etc. - depinde de tipul de document citat.
Referințe pentru articole originale din reviste publicate în format tipărit
Structura generală:
Numele autorului/autorilor urmate de inițiala prenumelui/prenumelor1. Titlul. Abrevierea jurnalului2. anul publicării revistei;volumul(nr.)3:paginile4.
1 Pentru inițiala/inițialele prenumelui nu se folosește spațiu și nici semne de punctuație între inițiale, autorii sunt separați prin simbolul, iar dacă sunt 7 sau mai mulți autori, se specifică doar primii 6 urmat de expresia: ‚ et al.
2 Pentru a afla abrevierea jurnalului se poate utiliza următorul link: https://www.ncbi.nlm.nih.gov/nlmcatalog/journals
3 numărul de apariții ale revistei de la lansarea ei (numărul apariției din anul curent)
4pagina de început și sfârșit a articolului
Exemplu:

Referința: Pompili M, Riccardi L, Covino M, Barbaro B, Di Stasi C, Orefice R, et al. Contrastenhanced gray-scale harmonic ultrasound in the efficacy assessment of ablation treatments for hepatocellular carcinoma. Liver Int. 2005;25(5):954-61.
Referințe pentru articole originale din reviste existente doar în format electronic
Structura generală:
Autor/i1. Titlul articolului. Numele abreviat al revistei [Internet] anul publicării [cited data citării2]; numărul volumului (numărul volumului din anul curent):identificator articol. Available from: adresa web.
1 pentru inițiala/inițialele prenumelui nu se folosește spațiu și nici semne de punctuație între inițiale, autorii sunt separați prin simbolul , iar dacă sunt 7 sau mai mulți autori, se specifică doar primii 6 urmat de expresia: ‚ et al.
2 de regulă data curentă
Opțional, dacă sunt disponibile, se pot adăuga informații de identificare ale documentelor electronice: Digital Object Identifier (DOI) – util pentru căutarea facilă în Internet, PubMed ID – număr unic de identificare în baza de date Medline/Pubmed, sau PubMed Central PMCID: doi: zzzzzzz. PubMed PMID: zzzzzzz; PubMed Central PMCID: PMC zzzzzzz.
Exemplu de referință de articol orginal din reviste publicate în format electronic:
Referința: Dudea D, Lasserre JF, Alb C, Culic B, Pop Ciutrila IS, Colosi H. Patients' perspective on dental aesthetics in a South-Eastern European community. J Dent [Internet] 2012 [cited 2018 Mar 2];40 Suppl 1:e72-81. DOI: 10.1016/j.jdent.2012.01.016. Available from: https://www.sciencedirect.com/science/article/pii/S0300571212000255?via%3Dihub
Referințe pentru cărți
Format general:
Autor/i1. Titlul cărții. Ediția2. Locul publicării3: Editura; anul publicației.
1 pentru inițiala/inițialele prenumelui nu se folosește spațiu și nici semne de punctuație între inițiale, autorii sunt separați prin simbolul , iar dacă sunt 7 sau mai mulți autori, se specifică doar primii 6 urmat de expresia: ‚ et al.
2 Dacă respectiva carte este la prima ediție, acest lucru nu se precizează
3 de regulă orașul
De regulă, toate informațiile necesare pentru realizarea referinței se regăsesc pe copertă și pe primele pagini.
Exemplu:

Eisen HN. Immunology: an introduction to molecular and cellular principles of the immune response. 5th ed. New York: Harper and Row; 1974.
Detalii cu privire stilul Vancouver pot fi accesate la adresa: https://www.nlm.nih.gov/bsd/uniform_requirements.html
Activitatea practică
Scopul și utilitatea laboratorului:
- Realizarea unei căutări după un scenariu utilizând metoda PICO.
- Crearea unei strategii de căutare care să identifice un număr cât mai mic de articole pe tema căutată.
- Utilizarea facilităților Clinical Queries și restrângerea căutarii în PubMed după criterii de interes (ex. tip articol, anul publicării, etc.).
- Dobândirea abilităților necesare scrierii referințelor conform standardului impus de stilul Vancouver
- Crearea unei fișe bibliografice cu cuprins pentru a regăsi ușor articolele de interes după titlu.
- Documentarea bibliografică pentru cercetare sau practica curentă
Pe serverul disciplinei în directorul Dvs. realizați un director LAB01. Descărcați fișierul de mai jos în acest director și completați spațiile albe. Salvați fișierul.
O parte din legăturile utile necesare sunt acestea:
- Interogarea PICO: https://pubmedhh.nlm.nih.gov/nlmd/pico/piconew.php
- Pubmed Clinical Query: https://www.ncbi.nlm.nih.gov/pubmed/clinical




